KİMYASAL BAĞLAR
Doğada elementleri tek başlarına bulmak neredeyse imkansızdır. Çoğu element başka bir elementle birleşerek kimyasal bağ yapar.
Elementlerin son katmanlarını dolu hale getirmek isterler. Örneğin 1 elektronu bulunan hidrojen tek katmana sahiptir ve o katmanın dolması için toplam 2 elektron olmalıdır.
Elementlerin son katmanlarını dolu hale getirmek isterler. Örneğin 1 elektronu bulunan hidrojen tek katmana sahiptir ve o katmanın dolması için toplam 2 elektron olmalıdır.
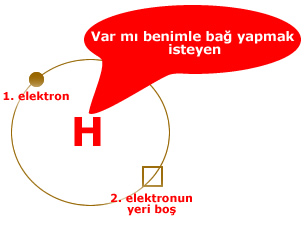
Bu nedenle hidrojen ihtiyaç duyduğu 1 elektronu başka bir elementle bağ yaparak sağlamak ister.
Hidrojenin bu çağrısı doğada asla cevapsız kalmaz. Hidrojen atomları başka elementlerle birleşerek, yani bağ yaparak elektron ihtiyaçlarını tamamlarlar.
Biz bu konumuzda gerçekleşen kimyasal bağların özelliklerinin neler olduğunu, hangi tip kimyasal bağların gerçekleştiğini açıklamaya çalışacağız.
1. İyonik Bağ
İyonik Bağ Nasıl Oluşur?
Atomlar son katmanlarını doldurmak isterler. Buna atomların kararlı hale geçmek istemesi de denir.
Bazı atomların son katmanlarında eksik elektron, bazı atomlarda da fazladan elektron bulunur.
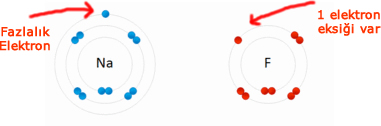
Yukarıdaki örnekte sodyumun(Na) son katmanında 8 olması gerekirken 1 elektronu var. Bu elektron fazlalık sayılır. Çünkü 1 elektronu dışarı verirse geriye tam dolu olan 2. katmanı kalır.
Flor(F) atomunda ise kon katmanda 8 olması gereken elektron sayısı 7 dir. Yani 1 elektrona daha ihtiyacı vardır.
Bazı atomların son katmanlarında eksik elektron, bazı atomlarda da fazladan elektron bulunur.

Yukarıdaki örnekte sodyumun(Na) son katmanında 8 olması gerekirken 1 elektronu var. Bu elektron fazlalık sayılır. Çünkü 1 elektronu dışarı verirse geriye tam dolu olan 2. katmanı kalır.
Flor(F) atomunda ise kon katmanda 8 olması gereken elektron sayısı 7 dir. Yani 1 elektrona daha ihtiyacı vardır.
Dikkat edersek Sodyum 1 elektrondan kurtulmak istiyor, Flor ise 1 elektron arıyor.
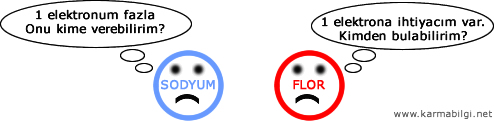

Sodyum fazlalık elektronu Flora verir.
Elektron veren sodyum artı (+) ; elektron alan flor eksi (-) yüklenir.
+ ve – birbirini çektiği için iki atom birbirine yapışır.
Bu sayede Flor ve Sodyum atomları arasında kimyasal bağ oluşur.
Elektron veren sodyum artı (+) ; elektron alan flor eksi (-) yüklenir.
+ ve – birbirini çektiği için iki atom birbirine yapışır.
Bu sayede Flor ve Sodyum atomları arasında kimyasal bağ oluşur.
Aşağıda iyonik bağ animasyon halinde aşamalı olarak gösterilmiştir. Dikkatle inceleyelim:
İyonik Bağ Kimler Arasında Oluşur?
- Metallerle ametaller arasında oluşur.
- + yüklü atomlarla – yüklü atomlar arasında oluşur.
- Anyon ve katyonlar arasında oluşur.
- Elektron alanlarla elektron verenler arasında oluşur.
- Son katmanında elektron fazlası olanlarla elektron eksiği olanlar arasında oluşur.
- Elektron alışverişi gerçekleşir.
İyonik bağı bir de animasyonla inceleyelim:
Animasyonda START tuşuna basarak elektron alışverişini gözlemleyebilirsiniz.
Animasyonda START tuşuna basarak elektron alışverişini gözlemleyebilirsiniz.
Burada Lityum ve Flor atomları arasında iyonik bağ gerçekleşmektedir.
İyonik bağ sadece iki atom arasında gerçekleşmez.
Bazen elektron alışverişini tamamlamak için ikiden fazla atoma ihtiyaç duyulur.
Aşağıdaki örneği inceleyelim:
Bazen elektron alışverişini tamamlamak için ikiden fazla atoma ihtiyaç duyulur.
Aşağıdaki örneği inceleyelim:
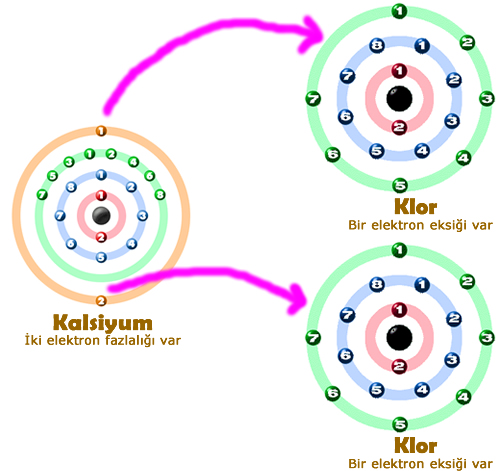
Yukarıdaki örneğe bakarsak, bir tane kalsiyum atomunun ihtiyacını ancak 2 tane klor giderebilmektedir.
Kalsiyumun 2 fazlalık elektronu, klorun da bir eksik elektronu bulunur. Kalsiyum fazlalık elektronlarını iki klor atomuna paylaştırır.
Bu nedenle bu üç atam arasında iyonik bağ oluşur. Oluşan bileşikte 1 tane kalsiyum, 2 tane klor atomu bulunur.
Kalsiyumun 2 fazlalık elektronu, klorun da bir eksik elektronu bulunur. Kalsiyum fazlalık elektronlarını iki klor atomuna paylaştırır.
Bu nedenle bu üç atam arasında iyonik bağ oluşur. Oluşan bileşikte 1 tane kalsiyum, 2 tane klor atomu bulunur.
İyonik bağ metal elementlerle ametal elementler arasında gerçekleşir. Bir atomun elektronu fazla, diğerinin az olması durumunda gerçekleşen iyonik bağda fazla elektronu olan az olana elektron verir. Bu sayede atomlar + ve – yüklerle yüklenirler.
Metaller + yüklü, ametaller ise – yüklüdür. Daha doğrusu metaller elektron verdikleri için +, ametallerde elektron aldıkları için – olurlar.
Metaller + yüklü, ametaller ise – yüklüdür. Daha doğrusu metaller elektron verdikleri için +, ametallerde elektron aldıkları için – olurlar.
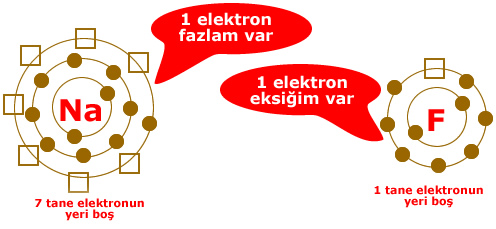
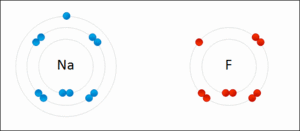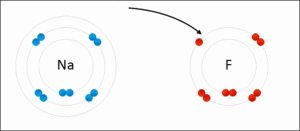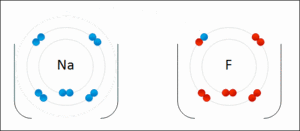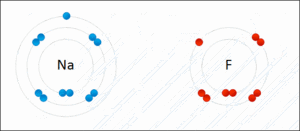
Resimde elektron dağılımı verilen sodyum(Na) ve flor (F) atomlarının elektronlarının sayısı konusunda sıkıntıları vardır. 2 atomun da son yörüngeleri tam dolu değildir.
Sodyum: Ya 7 elektron alarak son yörüngesini 8′e tamamlamalı ya da son yörüngesindeki 1 elektronu atarak 2 yörüngeli hale gelmelidir. 7 elektron almaktansa 1 elektron vermek kolay olduğu için sodyum 1 elektronunu flora verir.
Flor: Ya 7 elektron vererek tek yörüngeli hale gelmeli, ya da 1 elektron alarak son yörüngesini 8′e tamamlamalıdır. Florun 1 elektron alması 7 elektron vermesinden daha kolaydır. Bu nedenle flor sodyumdan 1 elektron alır.
Atomlar elektron alışverişi yaparak bağ oluşturduklarında Kararlı Hale Geçmiş olurlar. Atomların bileşik yapmış hali aşağıdaki gibidir.
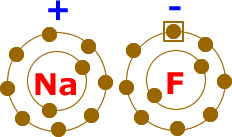
Elektron alışverişi yapılarak gerçekleşen bu iyonik bağda NaF bileşiği oluşmuştur. Na + yüklü ve metal; F ise – yüklü ve ametaldir.
2. Kovalent Bağ
Bazen atomların elektron alışverişi yapmak işlerine gelmez. Bunu şöyle düşünelim.
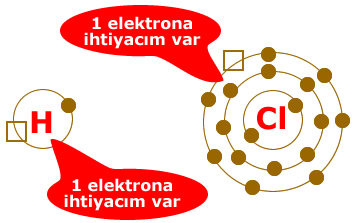
İki atom olsun ikisinin de elektron ihtiyacı olsun. Kimse diğerine elektron vermek istemez.
Böyle bir durumda atomların birbirine destek olması gerekmez mi? Evet iki atom birbirlerine destek olurlar ve elektronlarını ortaklaşa kullanarak ihtiyaçlarını giderirler.
Kovalent bağ ametallerin kendi aralarında yaptığı kimyasal bağdır. Elektronların ortaklaşa kullanılmasıyla olur.
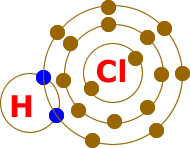
Bu bileşikte mavi renkle gösterilen elektronlar ortaklaşa kullanılır. Bu sayede Hidrojen son yörüngesini 2 ye tamamlayarak doldurur. Klor ise yine son yörüngesini 8′e tamamlayarak kararlı hale geçmiş olur.
Kimyasal bağlar ikiye ayrılır.
Bunlar iyonik bağ ve kovalent bağdır.
Bu konuda kovalent bağı öğreniyoruz.
Bunlar iyonik bağ ve kovalent bağdır.
Bu konuda kovalent bağı öğreniyoruz.
Atomlar son katmanlarının tam dolu olmasını ister.
(Buna atomların kararlı hale geçmek istemesi de denir.)
Soy gazlar hariç bütün atomların katmanlarında boşluk vardır.
Bu boşluğu doldurmak için atomlar başka atomlarla kimyasal bağ yapar.
Bir atom ya iyonik ya da kovalent bağ yapar.
(Buna atomların kararlı hale geçmek istemesi de denir.)
Soy gazlar hariç bütün atomların katmanlarında boşluk vardır.
Bu boşluğu doldurmak için atomlar başka atomlarla kimyasal bağ yapar.
Bir atom ya iyonik ya da kovalent bağ yapar.
Hangi atomlar kovalent bağ yapar?
Elektron eksiği bulunan atomların yaptığı kimyasal bağa KOVALENT BAĞ denir.
Aşağıdaki şekilleri inceleyelim.
Elektron eksiği bulunan atomların yaptığı kimyasal bağa KOVALENT BAĞ denir.
Aşağıdaki şekilleri inceleyelim.

Yukarıda görüldüğü gibi iki atomun da elektrona ihtiyacı vardır.
Bu iki atom kararlı hale geçmek için birer elektronlarını ortaklaşa kullanmak ister.
Sonuçta aşağıdaki gibi bir kimyasal bağ gerçekleşir.
Bu iki atom kararlı hale geçmek için birer elektronlarını ortaklaşa kullanmak ister.
Sonuçta aşağıdaki gibi bir kimyasal bağ gerçekleşir.

Hidrojen (H) ve Klor (Cl) birleşerek Hidrojen klorür isimli kovalent bağlı bileşiği oluşturdu.
Kovalent Bağ Çeşitleri
Tekli kovalent bağ
Ortaklaşa kullanılan elektronlar bir çifttir.
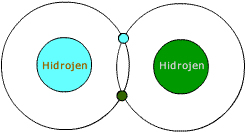
Hidrojenin tek katmanı vardır. Bu katmanda da sadece 1 elektronu bulunur.
Atomların 1. karmanı en fazla 2 elektron alabilir. Yani hidrojenin 1 elektrona daha ihtiyacı vardır.
Kendisi gibi başka bir hidrojen atomu bularak birer elektronlarını ortaklaşa kullanırlar. Böylece ikisinin de 2 tane elektronu varmış gibi olur.
İkili Kovalent Bağ
Ortaklaşa kullanılan elektronlar iki çifttir.
Ortaklaşa kullanılan elektronlar bir çifttir.

Hidrojenin tek katmanı vardır. Bu katmanda da sadece 1 elektronu bulunur.
Atomların 1. karmanı en fazla 2 elektron alabilir. Yani hidrojenin 1 elektrona daha ihtiyacı vardır.
Kendisi gibi başka bir hidrojen atomu bularak birer elektronlarını ortaklaşa kullanırlar. Böylece ikisinin de 2 tane elektronu varmış gibi olur.
İkili Kovalent Bağ
Ortaklaşa kullanılan elektronlar iki çifttir.
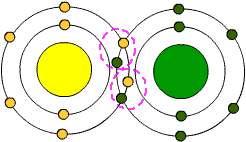
Yukarıdaki atomların son katmanlarında 6 elektronları vardır. Yani 2 elektron daha aramaktadırlar.
İkişer elektronlarını ortaklaşa kullanarak kararlı yapıya geçerler.
Üçlü kovalent bağ
Üç çift elektron ortaklaşa kullanılır.
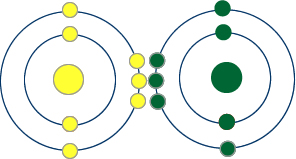
Bu atomların son katmanlarında 5 elektronları var. Kararlı olmaları için 8 olması gerekir.
başka bir atomla üçer elektronu ortak kullanarak kararlı hale geçebilirler.
Üç çift elektron ortaklaşa kullanılır.

Bu atomların son katmanlarında 5 elektronları var. Kararlı olmaları için 8 olması gerekir.
başka bir atomla üçer elektronu ortak kullanarak kararlı hale geçebilirler.
Polar ve Apolar Kovalent Bağ
Polar kelimesi “kutuplu” anlamına gelmektedir.
Polar kelimesi “kutuplu” anlamına gelmektedir.
Polar Kovalent Bağ
Eğer kovalent bağ yapan atomlar farklı atomlarsa polar kovalent bağ adı verilir
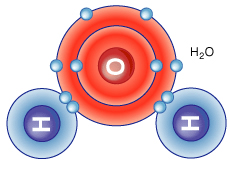
Eğer kovalent bağ yapan atomlar farklı atomlarsa polar kovalent bağ adı verilir

Apolar Kovalent Bağ
Kovalent bağı oluşturan atomlar aynı türse polar kovalent bağ oluşur.
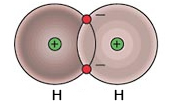
Kovalent bağı oluşturan atomlar aynı türse polar kovalent bağ oluşur.

Kovalent Bağın Özellikleri
- Ametallerin kendi aralarında yaptığı bağ çeşididir.
- Elektron ihtiyacı olan atomlar arasında gerçekleşir.
- - yüklü atomlar arasında gerçekleşebilir.
- Polar ve apolar olanları vardır.
- Aynı cins atomlar arasında gerçekleşebilir.
- Elektronlar ortaklaşa kullanılır.
DERS KİTAPLARI

Hiç yorum yok:
Yorum Gönder